Webinar UDI EUDAMED 2021 (Webinar | Online)
Kostenloses Webinar: Globale UDI Implementierung mit der richtigen Strategie und UDI Datenmanagement System
Die Einhaltung internationaler Anforderungen und Standards zur Gewährleistung der globalen UDI-Konformität stellt Medizinproduktehersteller vor eine riesige Herausforderung. Die sich ändernden Fristen und oft mehrdeutigen Richtlinien tragen zudem nicht dazu bei, sich Klarheit darüber zu verschaffen, was genau von einem verlangt wird.
EUDAMED mag sich verzögert haben, aber ein erfolgreiches Stammdatenmanagement mit Blick auf die globale UDI-Konformität ist immer noch ein komplexes Vorhaben. Um die Einhaltung der aktualisierten Zeitvorgaben sicherzustellen ist eine effektive Stammdatenstrategie sowie der Aufbau und die Pflege eines UDI Datenmanagementsystems unerlässlich. Dieses sollte nicht nur in der Lage sein UDI-Daten zu pflegen und zu validieren, sondern auch die Datenübertragung zu zahlreichen Datenbanken unterstützen. Leichter gesagt als getan.
Lernen Sie in diesem Webinar globale Lösungsansätze für die bevorstehenden Herausforderungen. Seien Sie am 26. Januar 2021 online dabei, wo auch immer auf der Welt Sie sich befinden, und hören Sie direkt von Experten wie Sie globale UDI-Compliance und effektives Stammdatenmanagement meistern können.
Agenda
UDI-World: Aktuell weltweite UDI Aktivitäten
Status quo EUDAMED (EU) und NMPA (China)
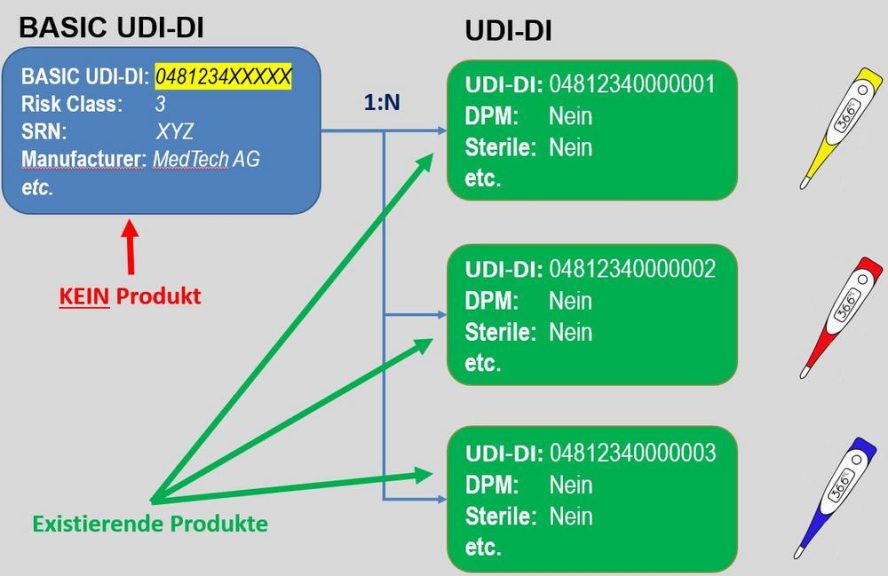
Strategie und Software gestützte Möglichkeiten für das UDI Datenmanagement
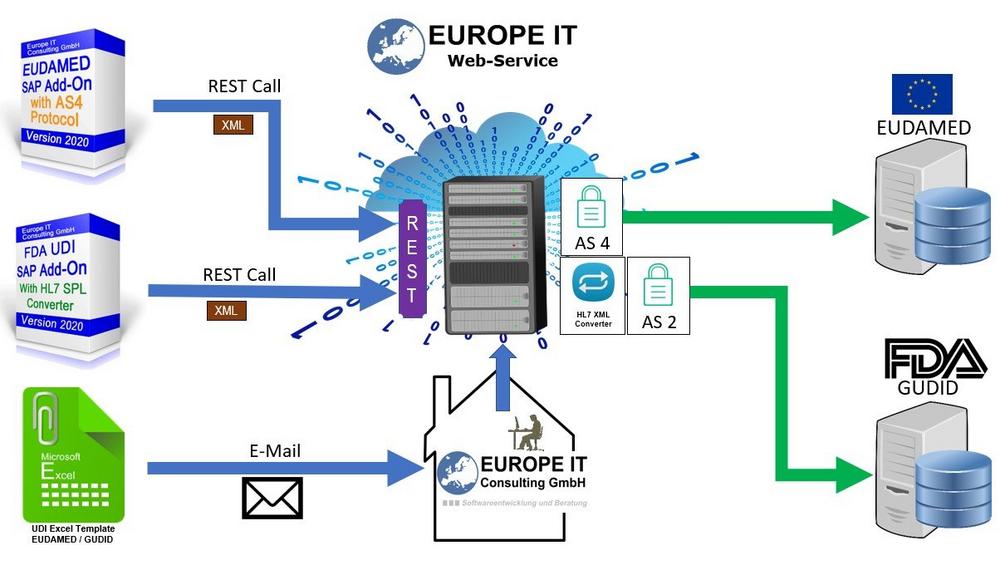
Datenübertragungsmöglichkeiten zu den Behörden (FDA, EC, NMPA)
Zielgruppe des Webinars
Dieses Webinar richtet sich an Fach- und Führungskräfte aus den Bereichen IT, Regulatory Affairs und
Qualitätsmanagement aus der Medizintechnik.
Teilnahmebedingung
Sie erhalten als Medizinproduktehersteller die Unterlagen kostenlos. Der Link zum Livestream wir Ihnen vor
dem Webinar per Mail zugesandt.
Melden Sie sich kostenlos für das Webinar auf unserer Webseite an: https://www.europe-it-consulting.ch/index.php/udi-webinar-2021/
Sie können den Termin nicht wahrnehmen? Melden Sie sich trotzdem kostenlos an und wir senden Ihnen gerne nach dem Webinar die Aufzeichnung zu.
Die Anmeldung erfolgt über Ihre Unternehmens E-Mail Adresse. Anmeldungen mit privaten E-Mail Adressen wie z.B. gmx.de, googlemail.com usw. werden nicht berücksichtigt. Dienstleister und Berater sind von der Teilnahme ausgeschlossen.
Eventdatum: Dienstag, 26. Januar 2021 10:00 – 10:45
Eventort: Online
Firmenkontakt und Herausgeber der Eventbeschreibung:
Europe IT Consulting GmbH
Steinentorstrasse 35
CH4051 Basel
Telefon: +41 (61) 508 73 34
http://europe-it-consulting.ch
Weiterführende Links
verantwortlich. Dieser ist in der Regel auch Urheber der Eventbeschreibung, sowie der angehängten
Bild-, Ton-, Video-, Medien- und Informationsmaterialien. Die United News Network GmbH
übernimmt keine Haftung für die Korrektheit oder Vollständigkeit des dargestellten Events. Auch bei
Übertragungsfehlern oder anderen Störungen haftet sie nur im Fall von Vorsatz oder grober Fahrlässigkeit.
Die Nutzung von hier archivierten Informationen zur Eigeninformation und redaktionellen Weiterverarbeitung
ist in der Regel kostenfrei. Bitte klären Sie vor einer Weiterverwendung urheberrechtliche Fragen mit dem
angegebenen Herausgeber. Eine systematische Speicherung dieser Daten sowie die Verwendung auch von Teilen
dieses Datenbankwerks sind nur mit schriftlicher Genehmigung durch die United News Network GmbH gestattet